Temodarは商品名であり、その成分本体はTemozolomideというイミドアゾテトラジン(imidazotetrazine)誘導体です。Temozolomideの化学名は3,4-dihydro-3-methyl-4-oxoimidazo[5,1-d]-as-tetrazine-8-carboxamideで以下のような構造をしています。
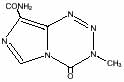
分子式:C6H6N6O2 分子量:194.15
TemozolomideはpH5以下の酸性条件では安定で、ph7以上のアルカリ条件下で急速に加水分解されて 活性型の 5-(3-methyltriazen-1-yl)imidazole-4-carboxamide (MTIC) に変換されます。
TemodarはTemozolomideをカプセルに詰めて内服薬とした製剤の商品名で、5 mg, 20 mg, 100 mg, 250 mg の temozolomideを含むカプセル製剤が販売されています。
Temodarカプセルには、Temozolomide以外に、lactose anhydrous, colloidal silicon dioxide, sodium starch glycolate, tartaric acid, stearic acidが安定剤として入っており、ゼラチンカプセルにはtitanium dioxideが含まれています。
臨床薬理:
1。作用機序
Temozolomideそのものは細胞毒性はありませんが、生理的pHで非酵素的に速やかに活性体のMTICに変換されます。MTICによる細胞毒性はDNAのアルキル化によって起こります。アルキル化(メチル化)はグアニン塩基のO6とN7に主に起こります。
2。薬物動態
Temozolomideは経口投与で速やかにかつ完全に消化管から吸収されます。空腹時に摂取した場合は血中濃度のピークは服用後1時間で見られます。
食事はtemozolomideの吸収の速度と量を減少させます。脂肪の多い食事の後に服用すると、ピークの血中濃度は32%減少し、最高濃度に達する時間も2時間以上になります。
Temozolomideは半減期1.8時間で急速に血中から排泄されます。
3。代謝と排泄
Temozolomideは生理的pHで自然に加水分解されて活性体の3-methyl-(triazen-1-yl)imidazole-4-carboxamide (MTIC)に変換され、さらに代謝されていきます。
MTIC はさらに加水分解されて 5-amino-imidazole-4-carboxamide (AIC)になり、これはプリン体と核酸の合成過程における中間産物であり、この物質がアルキル化作用を持っています。
肝臓の解毒酵素のCytochrome P450はこれらの代謝にはほとんど関与していません。
4。代謝の個人差など
年令は19〜78才まで、temozolomideの代謝にほとんど影響しません。
悪性星細胞腫の患者における臨床試験では、治療の最初のサイクルで、70才以上の高齢者では、高度の好中球減少と血小板減少が、70才以下の患者より多く発生しました。しかし、全体のデータでは、70才以上の患者に副作用が多くでるという傾向は見られませんでした。
体表面積で一致させて女性と男性と比べると、クリアランス(排泄速度)は女性の方が約5%低い値を示しました。
治療の最初のサイクルにおいて、高度(Grade 4)の好中球減少と血小板減少は女性の方に多く発生しました。
人種や喫煙の有無では代謝速度に差はみられませんでした。
高度の腎臓障害や透析患者での代謝は検討されていませんが、腎臓機能の低下した患者においては、temozolomideの使用は注意が必要です。
軽度から中等度の肝機能障害があってもtemozolomideの代謝に影響はみられません。しかし、高度の肝機能障害がある場合にはtemozolomideの服用は注意が必要です。
小児(3〜17才)は成人と同じ排泄速度を示しました。3才以下の幼児に関する検討は行われていません。
胃酸分泌を抑えるranichidine(商品名ザンタック)はtemozolomideの代謝に影響は与えませんでした。
抗てんかん薬のvalproic acid (商品名デパケン)はtemozolomideのクリアランスを5%減少させました。
デキサメサゾン(副腎皮質ホルモン)、プロクロルペラジン(吐気止め:ノバミン) フェニトイン(抗てんかん薬:アレビアチン、ヒダントール)、カルバマゼピン(抗てんかん薬:テグレトール)、オンダンセトロン(5-HT3受容体拮抗型制吐剤:ゾフラン)、H2-レセプター拮抗剤(ガスター、タガメット)、フェノバルビタール(鎮静・抗てんかん薬:フェノバール)とは併用しても、temozolomideの代謝やクリアランスには影響を与えませんでした。
5。臨床試験の結果
始めて再燃した悪性星細胞腫の患者で、全身状態がKarnofsky performance scaleで70%以上の162人について検討がなされました。
患者はそれまでには放射線治療やニトロソウレアなどの化学療法を受けていました。
54例はニトロソウレアとプロカルバジンによる治療を受けていましたが、腫瘍は進行し、抗癌剤に抵抗性の悪性星細胞腫と考えられていました。
この54例の平均年令は42歳(19〜76才)で65%が男性、72%の患者はKarnofsky performance scaleで80%以上でした。63%の患者は手術も受けており、切除手術を受けた患者のうち、73%は部分的な切除(subtotal resection)であり、27%は全体的な切除(gross total resection)でした。18%の患者は最初の再発の時に手術を受けています。最初の診断から最初の再発までの平均期間は13.8ヶ月(4.2〜75.4ヶ月)でした。
Temodarは28日サイクルで、最初の5日間は150 mg/m2/day (体表面積1m2当たり1日に150 mg )の薬を服用します。
2回目のサイクルの最初の日(スタートから29日目)およびそれまでの最低値で、好中球の数が1500/μl以上で、血小板数が10万/μl以上であれば、2回目のサイクルではTemodarは200 mg/m2/dayに増量して、5日間投与します。
治療抵抗性の悪性星細胞腫の患者全体で、反応率(完全寛解・著効+部分寛解・有効)は22%(54例中12例)で完全寛解(著効)は9%(54例中5例)でした。寛解期間の平均は50週(16〜114週)であり、完全寛解の平均期間は64週(52〜114週)でした。この集団において、癌が6ヶ月間進行停止した生存者の割合は45%、12ヶ月間進行停止した生存者の割合は29%でした。癌の進行が止まった期間の平均は4.4ヶ月でした。6ヶ月後の全体の生存率は74%、12ヶ月後の全体の生存率は65%でした。全体の平均生存期間は15.9ヶ月でした。
一般全身状態(Karnofsky Performance Scale)
100% 正常、臨床症状なし
90% 軽い臨床症状あるが、正常の活動可能
80% かなり臨床症状あるが、努力して正常の活動可能
70% 自分自身の世話はできるが、正常の活動・労働することは不可能
60% 自分に必要なことはできるが、ときどき介助が必要
50% 病状を考慮した看護および定期的な医療行為が必要
40% 動けず、適切な医療および看護が必要
30% 全く動けず、入院が必要だが死はさしせまっていない
20% 非常に重症、入院が必要で精力的な治療が必要
10% 死期が切迫している
0% 死
|
CR (Complete Response) 完全寛解・著効
すべての病変の100%縮小(消失)が4週間以上持続。
PR (Partial Response)部分寛解・有効
病変の50%以上の縮小が4週間以上持続。
(MR (Minor Response))
49〜25%縮小
NC (No Change) 不変
病変の50%未満の縮小または、25%未満の増大が4週間以上持続。
PD(Progressive Disease) 進行・増悪
最も縮小した時点から、25%以上の増大または、新病巣の出現。 |
適用:
Temodar(temozolomide)カプセルは治療抵抗性のanaplastic astrocytoma(悪性星細胞腫)の治療に適用されます。治療抵抗性というのは、ニトロソウレアやプロカルバジンを用いた化学療法にも反応せずに進行して再発した症例です。
この適用はanaplastic astorcytomaにおける反応率に基づいているだけで、この治療によって症状改善や延命期間の延長などの効果があるかどうかを示す臨床試験の結果はまだ出ていません。
禁忌:
Temodarカプセルに含まれる成分に対してアレルギー反応を示した既往のあるかたは使用できません。ダカルバジンに対してアレルギー反応を起こした既往のある方も使用は禁忌です。ダカルバジンもTemodarも 5-(3-methyltriazen-1-yl)imidazole-4-carboxamide (MTIC) に代謝されるからです。
警告:
Temodarで治療を受けた患者は骨髄抑制が起こることがあります。Temodar治療を受けるときには、好中球数が1500/μl以上、血小板数が10万/μl以上あることが絶対必要条件です。投与を開始してから21日目(最初の投与日をDay 1とするとDay22)あるいはその前後2日以内に血液検査で好中球数と血小板数をチェックしなければなりません。そして、好中球数が1500μml以上、血小板数が10万/μl以上になるまでは、毎週1回血液検査を行います。期間中に好中球数が1000/μl以下、血小板数が5万/μl以下になった場合には、Temodarの次のサイクルでの投与量は50 mg/m2分だけ減らします。ただし、100 mg/m2以下に減らすことはできません。100 mg/m2のTemodarに耐えられない患者はTemodar治療を受けることはできません。
高齢者と女性はTemodarによる骨髄抑制が起こりやすいという結果がでています。骨髄抑制は治療サイクルの後半で多く発生します。
数値が最低になる日数の平均は、temodar投与後、血小板は26日後(21〜40日)、好中球は28日(1〜44日)でした。
好中球や血小板の数の回復が悪いため、次のサイクルの投与が延期されたのは、それぞれ14%(158例中22例)と20%(158例中32例)でした。好中球と血小板の数が最低値になってから正常値に戻るのに要する日数は平均14日でした。
妊娠:Temozolomideは胎児に障害や奇形を引き起こす可能性がありますので、Temodarによる治療を受けている時には、妊娠しないようにしなければなりません。
注意:
最も頻度の高い副作用は吐気と嘔吐です。これらの副作用は自然に軽快するか、制吐剤を用いることによりコントロールできます。
カプセルをはずして中の成分を取り出してはいけません。もしカプセルがアクシデントで破損した場合には、中の成分を吸い込んだり、皮膚や粘膜に接触しないように注意が必要です。
薬は子供の手の届かない所に保存して下さい。
薬との相互作用では、valproic acid (商品名デパケン)はtemozolomideのクリアランスを5%減少させることが報告されています。
重度の肝機能障害や腎機能障害がある場合にはTemodarの投与は慎重に行うべきです。70才以上の高齢者はTemodar治療により骨髄抑制が起こりやすいので、高齢者に使用する場合には副作用について十分に注意を払う払わなければなりません。
血球数の検査は、Day 22(最初の投与日から21日目)に行なわなければなりません。もし、好中球数が1500μml以下、血小板数が10万μml以下になった場合には、数値が正常まで回復するまで毎週1回血液検査でチェックしなければなりません。
標準的な発癌性試験は行われていませんが、動物実験の結果から、temozolomideには発癌性があることが報告されています。細菌や培養細胞を用いた変異原性試験でも陽性に出ています。
生殖器に対する障害(精巣の萎縮など)も認められています。
妊娠中に服用すると胎児の障害や奇形が発生する危険があります。Temodar治療中は妊娠しないようにしなければなりません。
Temozolomideが母乳中に出てくるかどうかの検討は行われていません。しかし、多くの薬が母乳中に分泌され、それを飲んだ乳児に障害を起こす可能性がありますので、Temodar治療中は授乳はできません。
小児に対する安全性や有効性に関しては確立していません。
副作用:
158例の悪性星細胞腫の臨床試験でみられた副作用の発生率はTable 1と2に示しています。
この試験ではコントロール群が無いので、これらの症状が副作用によるものか、病気に起因するものかは確かではありません。しかしながら、吐気、嘔吐、倦怠、血液検査の異常は副作用によるものと考えられます。
最も頻度の高い副作用は吐気、嘔吐、頭痛、倦怠感です。これらの副作用の程度は軽度から中等度がほとんどで、自然に軽快したり、吐気や嘔吐は通常の制吐剤でコントロールできます。重度の吐気と嘔吐の頻度はそれぞれ10%と6%でした。
骨髄抑制(好中球減少と血小板減少)はTemodarの投与量を規定する副作用であり、
通常、治療を開始した初期に発生し、蓄積性はありません。
骨髄抑制は治療サイクルの後半に起こり、好中球と血小板の数が最低値になってから正常値に戻るのに要する日数は平均14日かかります。
数値が最低になる日数の平均は、Temodar投与後、血小板は26日後(21〜40日)、好中球は28日(1〜44日)でした。
好中球や血小板の数の回復が悪いため、次のサイクルの投与が延期されたのは、それぞれ14%(158例中22例)と20%(158例中32例)でした。好中球と血小板の数が最低値になってから正常値に戻るのに要する日数は平均14日でした。
骨髄抑制のために入院や輸血や治療の中断が必要であったのは10%以下でした。
70才以上の高齢者では、最初の治療サイクルで重度の好中球減少や血小板減少がそれぞれ7%と9.5%にみられました。70才以下では、最初の治療サイクルでは重度の好中球減少や血小板減少が発生する頻度は7%と5.5%でした。汎血球減少、白血球減少、貧血なども報告されています。
まれに、アレルギーによるアナフィラキシーショックや、結節性紅斑がみられたケースも発生しています。
Table 1
|
悪性星細胞腫の臨床試験における副作用(5%以上)
|
|
Temodar投与例(症例数158)
|
|
全症例(%)
|
グレード3/4(%)
|
|
153 (97)
|
79 (50)
|
頭痛
倦怠感
衰弱
発熱
背部痛 |
65 (41)
54 (34)
20 (13)
21 (13)
12 (8)
|
10 (6)
7 (4)
9 (6)
3 (2)
4 (3)
|
| 浮腫 |
17 (11)
|
1 (1)
|
けいれん
半身麻痺
めまい
筋肉運動異常
健忘
不眠
感覚異常
眠気
不全麻痺
排尿障害
運動失調
失語症
局所けいれん
歩行障害
混乱
|
36 (23)
29 (18)
19 (12)
17 (11)
16 (10)
16 (10)
15 (9)
15 (9)
13 (8)
13 (8)
12 (8)
11 (7)
9 (6)
9 (6)
8 (5)
|
8 (5)
10 (6)
1 (1)
2 (1)
6 (4)
0
1 (1)
5 (3)
4 (3)
3 (2)
3 (2)
1 (1)
0
1 (1)
0
|
| 副腎機能亢進 |
13 (8)
|
0
|
吐き気
嘔吐
便秘
下痢
腹痛
食欲不振 |
84 (53)
66 (42)
52 (33)
25 (16)
14 (9)
14 (9)
|
16 (10)
10 (6)
1 (1)
3 (2)
2 (1)
1 (1)
|
| 体重増加 |
8 (5)
|
0
|
| 筋肉痛 |
8 (5)
|
|
不安
うつ状態 |
11 (7)
10 (6)
|
1 (1)
0
|
| 乳房痛(女性) |
4 (6)
|
|
| ウイルス感染 |
17 (11)
|
0
|
上気道感染
咽頭炎
副鼻腔炎
咳き |
13 (8)
12 (8)
10 (6)
8 (5)
|
0
0
0
0
|
発疹
掻痒 |
13 (8)
12 (8)
|
0
2 (1)
|
尿路感染
頻尿 |
12 (8)
9 (6)
|
0
0
|
複視
視覚異常 |
8 (5)
8 (5)
|
0
|
Table 2
|
血液学的異常(グレード3と4)
|
| ヘモグロビン |
7/158 (4%)
|
| 好中球 |
20/142 (14%)
|
| 血小板 |
29/156 (19%)
|
| 白血球 |
18/158 (11%)
|
過剰投与:
5日間の総量が500, 750, 1,000, 1,250 mg/m2 の場合で検討が行われました。用量を規定する毒性は骨髄抑制による好中球減少と血小板減少であり 1,000 mg/m2と1,250 mg/m2(5日間の総量)においてその毒性が問題となりました。Temodarを単独で1,000 mg/m2投与した場合には、好中球と血小板の減少は予測できる範囲でした。それ以上の過剰投与の場合には、血球数の厳重なチェックが必要であり、必要に応じて骨髄抑制を補助する治療が考慮されなければなりません。
用量と投与法:
Temodarの投与量は、その前の治療サイクルにおける好中球と血小板数の最小値と、治療を開始する当日の好中球と血小板数の値によって決定されます。
Temodarの最初の投与量は体表面積1m2あたり150mgを1日量として5日間連続して内服し、6日目から28日目までは休薬します。
この28日間の治療サイクルにおける好中球の最小値と、次の治療を開始する日(29日目)の好中球の値が1500 μml以上であり、かつ、治療サイクルにおける血小板の最小値と、次の治療を開始する日(29日目)の血小板の値が10万 μml以上であれば、次の治療サイクルでは、Temodarの投与量を1日当たり200 mg/m2に増量して5日間連続して投与することが可能です。
治療中は、開始日をDay 1とするとDay 22(投与を開始した日の21日後)か、その日に検査できなければDay 22の48時間以内に血球数の測定を行わなければなりません。そして、その後は好中球数が1500 μml以上、血小板数が10万 μml以上になるまで、毎週1回血球数を測定します。好中球と血小板の値がこのレベルを超えるまでは、Temodarの次の投与を開始することはできません。
治療期間中に、好中球が1000 μml以下あるいは血小板が5万 μml以下に低下することが一度でもあれば、次の治療サイクルではTemodarの1日量を50 mg/m2だけ減らします。しかし、1日量100 mg/m2が推奨される治療量の最低量ですので、100 mg/m2/日以下に減らすことはできません。
Temodar治療は癌の進行が始まるまで継続することができます。
臨床試験では最長2年間の治療が可能でしたが、治療の最適期間は現時点では不明です。
Temodarの投与量は体表面積に基づいて計算されます。
Table 3:投与量決定法
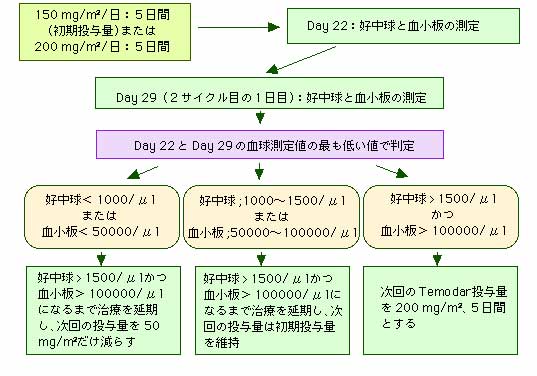
Table 4:Temodar治療の最初の治療サイクルにおける体表面積当たりの投与量(150 mg/m2)の計算式。この表に示されたTemodarの量を28日間サイクルの最初の5日間に毎日投与する。Day 22とDay29に測定した好中球数が1500 μml以上、血小板数が10万 μml以上であれば、次のサイクルは 200mg/m2のTemodarを5日間投与する。
| 体表面積別のTemodar投与量 |
|
体表面積
(m2) |
150 mg/m2
(1日投与量) |
200 mg/m2
(1日投与量) |
| 0.5 |
75 |
100 |
| 0.6 |
90 |
120 |
| 0.7 |
105 |
140 |
| 0.8 |
120 |
160 |
| 0.9 |
135 |
180 |
| 1.0 |
150 |
200 |
| 1.1 |
165 |
220 |
| 1.2 |
180 |
240 |
| 1.3 |
195 |
260 |
| 1.4 |
210 |
280 |
| 1.5 |
225 |
300 |
| 1.6 |
240 |
320 |
| 1.7 |
255 |
340 |
| 1.8 |
270 |
360 |
| 1.9 |
285 |
380 |
| 2.0 |
300 |
400 |
| 2.1 |
315 |
420 |
| 2.2 |
330 |
440 |
| 2.3 |
345 |
460 |
| 2.4 |
360 |
480 |
| 2.5 |
375 |
500 |
|
Table 5:1日量に基づくTemodarカプセルの組み合わせ方
| 1日投与量に基づくカプセルの組み合わせ |
|
|
カプセル内容量(mg)別の組み合わせ
|
| 1日投与量 (mg) |
250 mgカプセル |
100 mgカプセル |
20 mgカプセル |
5 mgカプセル |
| 200 |
0 |
2 |
0 |
0 |
| 205 |
0 |
2 |
0 |
1 |
| 210 |
0 |
2 |
0 |
2 |
| 215 |
0 |
2 |
0 |
3 |
| 220 |
0 |
2 |
1 |
0 |
| 225 |
0 |
2 |
1 |
1 |
| 230 |
0 |
2 |
1 |
2 |
| 235 |
0 |
2 |
1 |
3 |
| 240 |
0 |
2 |
2 |
0 |
| 245 |
0 |
2 |
2 |
1 |
| 250 |
1 |
0 |
0 |
0 |
| 255 |
1 |
0 |
0 |
1 |
| 260 |
1 |
0 |
0 |
2 |
| 265 |
1 |
0 |
0 |
3 |
| 270 |
1 |
0 |
1 |
0 |
| 275 |
1 |
0 |
1 |
1 |
| 280 |
1 |
0 |
1 |
2 |
| 285 |
1 |
0 |
1 |
3 |
| 290 |
1 |
0 |
2 |
0 |
| 295 |
1 |
0 |
2 |
1 |
| 300 |
0 |
3 |
0 |
0 |
| 305 |
0 |
3 |
0 |
1 |
| 310 |
0 |
3 |
0 |
2 |
| 315 |
0 |
3 |
0 |
3 |
| 320 |
0 |
3 |
1 |
0 |
| 325 |
0 |
3 |
1 |
1 |
| 330 |
1 |
0 |
4 |
0 |
| 335 |
1 |
0 |
4 |
1 |
| 340 |
0 |
3 |
2 |
0 |
| 345 |
0 |
3 |
2 |
1 |
| 350 |
1 |
1 |
0 |
0 |
| 355 |
1 |
1 |
0 |
1 |
| 360 |
1 |
1 |
0 |
2 |
| 365 |
1 |
1 |
0 |
3 |
| 370 |
1 |
1 |
1 |
0 |
| 375 |
1 |
1 |
1 |
1 |
| 380 |
1 |
1 |
1 |
2 |
| 385 |
1 |
1 |
1 |
3 |
| 390 |
1 |
1 |
2 |
0 |
| 395 |
1 |
1 |
2 |
1 |
| 400 |
0 |
4 |
0 |
0 |
| 405 |
0 |
4 |
0 |
1 |
| 410 |
0 |
4 |
0 |
2 |
| 415 |
0 |
4 |
0 |
3 |
| 420 |
0 |
4 |
1 |
0 |
| 425 |
0 |
4 |
1 |
1 |
| 430 |
1 |
1 |
4 |
0 |
| 435 |
0 |
4 |
1 |
3 |
| 440 |
0 |
4 |
2 |
0 |
| 445 |
0 |
4 |
2 |
1 |
| 450 |
1 |
2 |
0 |
0 |
| 455 |
1 |
2 |
0 |
1 |
| 460 |
1 |
2 |
0 |
2 |
| 465 |
1 |
2 |
0 |
3 |
| 470 |
1 |
2 |
1 |
0 |
| 475 |
1 |
2 |
1 |
1 |
| 480 |
1 |
2 |
1 |
2 |
| 485 |
1 |
2 |
1 |
3 |
| 490 |
1 |
2 |
2 |
0 |
| 495 |
1 |
2 |
2 |
1 |
| 500 |
2 |
0 |
0 |
0 |
臨床試験では、Temodarの投与は空腹時と非空腹時に行われました。
しかし、薬の吸収は食事により影響を受けるので(臨床薬理の項を参照)、投与時の食事の状況を一致させることが推奨されます。
Temodar治療においては、制限すべき食事はありません。吐き気や嘔吐を減らすためTemodarは空腹時に内服すべきです。就寝時の内服が推奨されます。Temodar服用の前か後に制吐剤(吐き気止め)を併用することも有用です。
Temodarカプセルを開けたり、口の中で噛んではいけません。(口腔内や食道の粘膜を障害するため)水と一緒にカプセルを飲み込みます。
取り扱いと廃棄:
Temozolomideをラットに投与すると悪性腫瘍が発生します(つまり、発癌性があります)。
カプセルを開けてはいけません。もし、カプセルが間違って開いたり破損した場合には、中身の成分(Temozolomide)を吸い込んだり、皮膚や粘膜に接触しないように厳重な注意が必要です。抗癌剤の適切な取り扱いや廃棄について十分に考慮しなければなりません。
(訳者注:抗癌剤の取り扱いや廃棄に関しては幾つかのガイドラインがありますが、推奨されている方法の必要性や適切性についてのコンセンサスが得られているわけではありません。基本的には、医療用廃棄物として廃棄すべきと考えますので、不要になった薬は処方医に返却して、医療用廃棄物として処分されるべきものと考えます。カプセル破損による皮膚や粘膜の障害が発生した場合には、その障害の程度に応じて医療的処置が必要になる場合があります)
脳腫瘍や悪性黒色腫に対するサリドマイドやテモダールの効果に関する最近の報告の要旨を以下に和訳しています。どの程度の効果が期待できるかの参考になると思います。
| Temozolomide as an alternative to irradiation for elderly patients with newly diagnosed malignant gliomas.(新たに診断された悪性神経膠腫の高齢患者に対する放射線治療の代替としてのTemozolomide)Cancer 97:2262-2266, 2003 |
要旨:
【背景】悪性神経膠腫の高齢患者(70歳以上)に対する適切な治療法については議論が多い。高齢者は放射線療法に耐えることが困難な場合が多いので、保存的な治療を推奨する医師も存在する。悪性神経膠腫に対して有効な新しいアルキル化剤であるtemozolomideはこのような患者に対して他の治療法の可能性を提示している。この薬は自宅で経口的に投与され、生命に危険を及ぼす副作用も少ない。
【研究の方法】86例の高齢の悪性神経膠腫の患者に対して検討を行った。このうち、32例は放射線治療の代わりに1ヶ月間のtemozolomide治療を受けた。
【結果】放射線治療のグループとtemozolomide治療のグループの間で生存率に違いはなかった。
temozolomide治療の方が毒性は低く、より多くの患者が自宅で死亡した。
【結論】高齢の悪性神経膠腫の患者に対して、temozolomide治療は放射線治療と同じくらいの有効性を示す。経口的に投与できるという点と、副作用による死亡率が低いという点で、temozolomide治療は放射線治療より優れており、放射線治療に代わりうる治療法といえる。
Phase II Trial of Temozolomide in Patients With Progressive Low-Grade Glioma.
(進行性の低悪性度神経膠腫に対するTemozolomide治療のフェースII臨床試験)
J Clin Oncol 21(4):646-651, 2003 |
要旨:
【目的】Temozolomide (Temodar; Schering-Plough Corp, Kenilworth, NJ) は imidazole tetrazinoneであり、体内でメチル化活性を持つ物質5-(3-methyltriazen-1yl)imidazole-4-carboximideに変換される。今までの研究で、進行性の新たに診断された悪性神経膠腫の治療に対してTemodarの有効性は確認されている。この研究をさらに進めて、進行性のlow-grade glioma(低悪性度神経膠腫)の患者に対するフェースII臨床試験を行った。
【患者と方法】Temodarは5日間連続で1日1回空腹時に内服した。初回は1日量が200 mg/m2であった。この治療を28日周期でくり返し行った。有効性の評価はMRIによる画像診断と身体所見の検査で行った。
【結果】
low-grade gliomaの46例の患者について検討した。治療に反応した割合は61%(complete responseは24%、partial responseは37%)であり、さらに、35%の患者は進行が止まった。
無進行期間(Progression-free survival, PFS)の中間値は22ヶ月であり、98%は6ヶ月間のPFSであり、76%は12ヶ月のPFSであった。この研究期間に見られた毒性は軽度であり、6例の患者に見られたのみであった。3例はgrade 3 の白血球減少を呈し、2例でgrade 3 の血小板減少がみられた。1例は頭蓋内出血、白血球減少、血小板減少、敗血症を併発して死亡した。
【結論】low-grade gliomaに対してTemodarは有効と考えられ、したがってこの薬のさらなる評価が必要である。
| Temozolomide plus thalidomide in patients with advanced melanoma: results of a dose-finding trial.(進行したメラノーマに対するtemozolomideとサリドマイドの併用:用量決定のための試験)J Clin Oncol 2002 Jun 1;20(11):2610-5 |
要旨:
【目的】手術不能のatage III またはIVの悪性黒色腫患者における、経口の細胞毒性(cytotoxic)薬物であるtemozolomideと細胞静止性(cytostatic)薬剤のサリドマイドの安全性と用量を決定するために検討した。
【患者と方法】
脳転移を認めない手術不能のatage III またはIVの悪性黒色腫患者において、temozolomideは50 mg/m2/dayの6週間投与と4週間の休薬、75 mg/m2/dayの6週間投与と4、3、2週間の休薬、というスケジュールで用量と投与期間を変えて検討。サリドマイドは1日200 mgから開始して、400 mgまで増量した。安全性と効果を評価した。
【結果】70才以下では、サリドマイドは400 mg/日まで重大な副作用もなく、70才以上でも、200 mg/日では安全に投与可能であった。多い副作用は便秘と神経障害であった。12例中5例に有効であり(1例は完全緩解、4例は部分緩解)、緩解期間は平均6ヶ月であり、平均生存期間は12.3ヶ月であった。
【結論】temozolomideとサリドマイドの併用療法は、安全性に問題は無く、進行したメラノーマにも抗腫瘍効果を示した。
Schering-Plough 研究所は、種々の癌に対するTemodar (temozolomide)カプセルの効果を検討した臨床試験の結果を発表した。Temodarに関する36の臨床試験結果の概要が、米国臨床癌学会(ASCO)の第37回年次総会で発表された。
『これらの研究はまだ予備試験の段階であるが、Temodarが非常に悪性度の高い癌の幾つかに適用できる可能性があることに、我々は非常に期待している』と、Schering-Plough研究所のJean-Jacques Garaud医学博士は述べている。『Temodarの効果をさらに検討するために、研究が進行している』
米国のFDA(食品医薬品局)は1999年、Temodarを治療抵抗性の悪性星細胞腫の成人の治療への認可を早めることを承諾した。治療抵抗性の悪性星細胞腫というのは、ニトロソウレアやプロカルバジンで治療した後、癌が再発して進行している患者たちである。Temodarの治療効果は、現時点では患者に使用した場合の反応率(奏功率)にすぎず、再発した悪性星細胞腫におけるランダム化二重盲検試験において、症状改善や延命効果や癌の進展抑制の効果が証明されているわけでは無い。
Temodarはこの種類の脳腫瘍に適用される薬としては、米国では20年ぶりに新たに認可された薬である。Temozolomideは経口の細胞毒性物質で、イミダゾテトラジン系アルキル化剤の第2世代というべき薬剤である。細胞毒性治療というのは、癌細胞のように早い速度で増殖(細胞分裂)している細胞の分裂を妨げるように計画された治療である。
Schering-Plough社は、イギリスのCancer Research Campaign Technology, Ltd.からtemozolomideの世界中における販売権を得ている。
Temodarを用いた悪性星細胞腫の試験において、投与量を規定する副作用は骨髄抑制(血小板減少)であった。この副作用は通常、治療を開始した最初の数サイクルで起こり、累積性はなく、14日以内に回復することが多い。
骨髄抑制による入院や輸血や治療の中断が生じたのは、temozolomide治療を受けた患者の10%以下であった。
最も多い副作用は吐気(53%)、嘔吐(42%)、頭痛(41%)、倦怠(34%)、便秘(33%)であり、これらの症状が強くでるのは10%以下であった。吐気や嘔吐は通常の制吐剤をtemodar服用前に使用すれば容易にコントロールすることが可能であった。
oligodendroglioma(乏突起細胞腫)、low-grade glioma(低悪性度神経膠腫)、新たに診断されたglioblastoma multiforme(多形神経膠腫)などの治療におけるtemozolomideの研究結果がASCOで発表された。さらに、新たな投与スケジュール法の結果も報告された。
癌患者の20〜40%において脳への転移が起こる。癌の治療効果が良くなって癌患者の生存期間が延びるに従い、転移性脳腫瘍の頻度も増加している。
『転移性脳腫瘍という困難な病気に立ち向かうためには、既存の治療を改良し、さらに新たな方法を開発して、より多くの選択肢が得られるようにすることが重要である』と国立脳腫瘍研究所のRobert Tufel博士は述べている。
ASCOで発表された2つの転移性脳腫瘍におけるフェースII研究では、放射線治療と併用した場合の安全性や効果が検討された。現時点では、転移性脳腫瘍に対する治療は放射線照射が最も有効である。転移性脳腫瘍に対する放射線治療の補助としてtemozolomideの有効性を評価する研究も進行中である。
転移性メラノーマは、皮膚癌全体の5%であるのに、皮膚癌関連死亡の75〜85%を占めており、皮膚癌の中でもっとも治療困難で死亡率の高い腫瘍といえる。
ASCOではtemozolomideとサリドマイドの併用療法のフェースI試験の結果が発表された。サリドマイドは生体反応を調整して細胞機能に影響し、転移性メラノーマの治療にも有用である。
インターフェロン、シスプラチン、ビンブラスチン、インターロイキン-2などとtemozolomideを併用したフェースII試験の結果も発表された。
非小細胞性肺癌の多くは再発し、その場合の治療は困難であり結果は悲惨である。進行した再発非小細胞性肺癌の難治例におけるtemozolomideの予備試験の結果も報告された。
急性白血病は、骨髄や脾臓やリンパ節において、白血病細胞が急速に増殖する病気である。治療抵抗性で再発した急性白血病の治療に、強力な化学療法の代替としてtemozolomideが有効である可能性を示す予備試験の結果も報告された。
癌は多くの場合、複数の方法で治療される。違ったメカニズムの薬剤を組み合わせれば、相加効果や相乗効果によって治療効果を高めることができる論理的根拠がある。
CPT-11 (irinotecan), VP-16 (etoposide), topotecan, cisplatin, gemcitabine, vinorelbine, paclitaxel, thalidomideなどとのtemozolomideの併用が検討され、その結果がASCOで発表された。
![]()

