ヒドロキシクエン酸の抗がん作用
がん細胞の脂肪合成を阻害してがん細胞の増殖を抑える治療法
【脂肪酸合成を阻害するとがん細胞は死滅する】
がん細胞では脂肪酸の新規合成が盛んです。脂肪酸合成酵素(fatty acid synthase: FASN)をはじめ、幾つかの脂質代謝酵素ががんの発生や悪性化を促進することが知られており、これらががん治療の新たな標的分子となる可能性が期待されています。特にATP クエン酸リアーゼの阻害が、がん治療に有効という報告があります。
クエン酸からアセチルCoAに変換する酵素がアデノシン3リン酸クエン酸リアーゼ(ATP:citrate oxaloacetate lyase, EC 4.1.3.8)です。
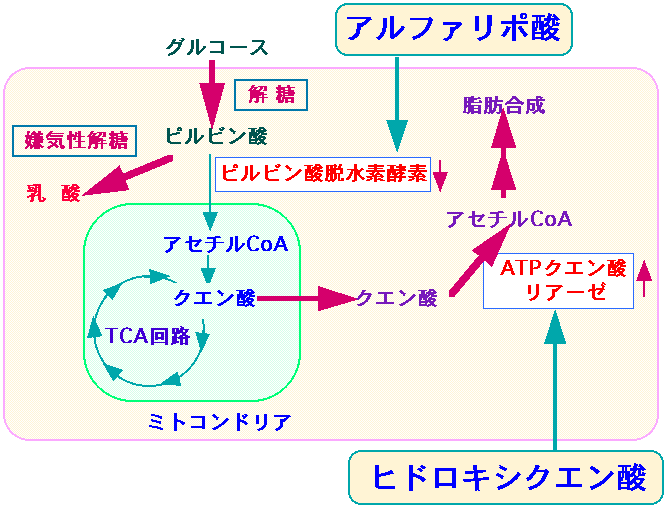
食事から摂取したグルコース(ブドウ糖)は、解糖系を経てミトコンドリアのクエン酸サイクル(TCA回路)によりエネルギー(ATP)に変換されます。生成したエネルギーは体が必要とするエネルギーとして利用され消費されますが、その消費量が少ない場合には、グルコースはクエン酸に変換された後、ミトコンドリアを出て脂肪合成の場である細胞質へ移行し、アセチルCoAを経由して脂肪酸そして脂肪、あるいは、コレステロールに変換され、体内に蓄積されます。
アセチルCoAはミトコンドリアを通過できないのですがクエン酸は通過できます。TCAサイクルでできたクエン酸がミトコンドリアの外に出て、ATPクエン酸リアーゼによって脂肪の合成に使用されるのです。(下図)。
TCA回路で作られるクエン酸から脂肪合成を行う最初のステップに働く酵素がATPクエン酸リアーゼ。
がん細胞は細胞の数を増やすために脂肪合成が亢進しており、ATPクエン酸リアーゼの活性が高くなっている。 ATPクエン酸リアーゼを阻害すると、脂肪の合成を阻害し、がん細胞の増殖を抑えることができる。糖質を摂取し過ぎると肥満になり易い理由は、ブドウ糖がTCA回路でクエン酸になって、これがATPクセン酸リアーゼで脂肪酸に変換されるからです。 がん細胞が分裂して細胞を増やすためには、DNAや細胞膜など多くの細胞成分を合成する必要があります。脂肪も細胞を作るのに必須で、そのため、脂肪合成に重要な酵素であるATPクエン酸リアーゼは多くのがん細胞で活性が亢進していることが報告されています。
したがって、ATPクエン酸リアーゼの阻害は、がん細胞の増殖を抑制する効果が期待できます。実際に、培養がん細胞を使った実験や、移植腫瘍を使った動物実験などで、ATPクエン酸リアーゼの阻害ががん細胞の増殖を抑制する効果があることが報告されています。 ATPクエン酸リアーゼの阻害剤として、ガルシニア・カンボジアに含まれる(-)-ヒドロキシクエン酸があります。
【ATPクエン酸リアーゼを阻害するヒドロキシクエン酸】
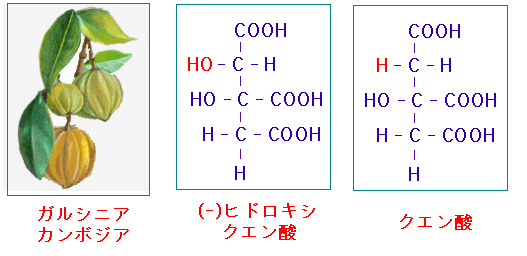
ガルシニア・カンボジア(Garcinia cambogia)の果皮に多量に含まれる(-)-ヒドロキシクエン酸((-)- Hydroxycitric acid、HCA)は、クエン酸より水酸基(-OH)を一つ多く持っている点が違うだけで化学構造が類似しているため、ATPクエン酸リアーゼの酵素活性を競合阻害することが知られています。
ガルシニア・カンボジアはインドや東南アジアに生育する常緑樹で、5~9月頃にオレンジ大の大きさで黄色からやや赤みがかった実をつけます。果実や果皮は柑橘類に似た強い酸味を有し、熟果は果物として生食されるほか、果皮や実は乾燥させて貯蔵し、カレーの酸味付けや魚の塩蔵保存などにも用いられ、長年にわたりスパイスとして利用されています。インド伝統医学のアーユルヴェーダでは消化を助け食欲を抑える薬として使用されています。
乾燥したガルシニアの果皮には10~30%ものヒドロキシクエン酸を含まれています。 ヒドロキシクエ ン酸は分子内に不斉炭素を有するため4つの異性体が存在しますが、ATPクエン酸リアーゼの阻害効果を持つのは(-)-ヒドロキシクエン酸(HCA)のみです。ガルシニア・カンボジアの果皮あるいはヒドロキシクエン酸は脂肪の合成を阻害するので、肥満抑制効果が期待されてダイエットのサプリメントに利用されています。さらに近年、がんの治療にも役立つことが報告されています。
熱帯植物ガルシニア・カンボジアの果実に多く含まれる(-)-ヒドロキシクエン酸はクエン酸と競合阻害することによってATPクエン酸リアーゼを阻害することができる。
【アルファリポ酸とヒドロキシクエン酸の併用は抗がん作用を強める】
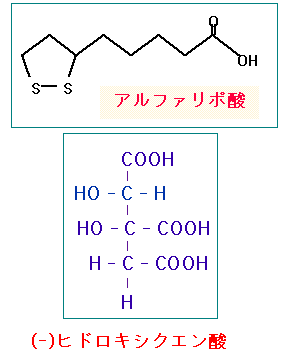
アルファリポ酸は、多数の酵素の補助因子として欠かせない体内成分で、特にTCA回路(クエン酸回路)のピルビン酸脱水素酵素複合体の補助因子として、ミトコンドリアでのエネルギー産生に重要な役割を果たしています。糖代謝の促進や抗酸化作用があるので、ダイエット効果や抗老化や美容を目的としたサプリメントとしても人気があります。
一方、ヒドロキシクエン酸は、ガルシニア・カンボジアの果皮に多量に含まれる成分で、クエン酸より水酸基(OH)を一つ多く持っている点が違うだけで化学構造が類似しているため、ATPクエン酸リアーゼの酵素活性を競合阻害することが知られています。
ATPクエン酸リアーゼ(ATP citrate lyase)は細胞内でクエン酸から脂肪合成を行う最初のステップに必要な酵素で、ATPクエン酸リアーゼを阻害すると脂肪の合成が阻害されます。したがって、ヒドロキシクエン酸も体脂肪を減らすサプリメントとして人気があります。
ダイエット効果のあるこれら2種類のサプリメント(アルファリポ酸とヒドロキシクエン酸)が、がん治療においても効果があることが報告されています。その理由は、細胞内の物質代謝やエネルギー産生において、正常細胞とは異なるがん細胞の特徴にあります。
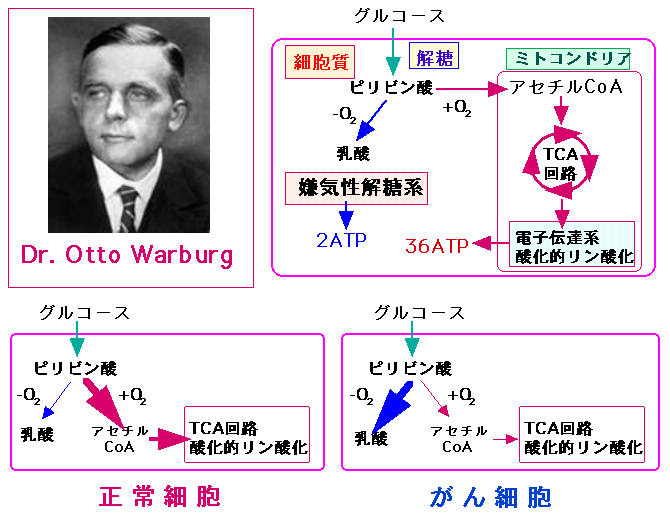
その特徴とは、1)ピルビン酸脱水素酵素の活性低下と、2)ATPクエン酸リアーゼの活性亢進です。 がん細胞では、ピルビン酸脱水素酵素の活性が低下し、その結果、ミトコンドリアでのTCA回路と酸化的リン酸化による酸素を使ったエネルギー産生(ATP産生)が低下し、酸素を使わない嫌気性解糖系でのエネルギー(ATP)産生が亢進しています。 がん細胞では、酸素が十分にある状態でも、酸素を使わない嫌気性解糖系でのエネルギー産生(ATP産生)が亢進していることを約80前にオットー・ワールブルグが発見し、ワールブルグ効果として知られています。
また、ATPクエン酸リアーゼの活性亢進は、がん細胞が分裂して細胞を増やすときに必要な脂肪の合成を高めるためと考えられます。したがって、ATPクエン酸リアーゼの活性を阻害すると、脂肪の合成が阻害されてがん細胞の増殖を抑えることができます。 さらに、ピルビン酸脱水素酵素の活性を高め、ATPクエン酸リアーゼの活性を阻害して、ミトコンドリアでのTCA回路と酸化的リン酸化が正常化すると、がん細胞はアポトーシスを起こしやすくなることが知られています。
図:がん細胞では嫌気性解糖系が亢進し、ピルビン酸脱水素酵素の活性が低下し、ATPクエン酸リアーゼの活性が亢進している。ピルビン酸脱水素酵素の活性を高めるアルファリポ酸と、ATPクエン酸リアーゼを阻害するヒドロキシクエン酸を併用すると、がん細胞の増殖を抑えることができる。抗がん剤治療と併用して抗腫瘍効果を高めることができる。
以上のことから、ピルビン酸脱水素酵素の活性を高めるアルファリポ酸と、ATPクエン酸リアーゼの活性を阻害するヒドロキシクエン酸を併用すると、がん細胞の増殖を抑えることが推測されます。実際に、この仮説を検証している研究グループがあり、その研究結果によると、『アルファリポ酸とヒドロキシクエン酸の併用は通常の抗がん剤に匹敵する抗がん作用を示す』『アルファリポ酸とヒドロキシクエン酸の併用は抗がん剤の効き目を高める』という結果が得られています。以下にその論文を紹介します。
【要旨】
がん細胞におけるエネルギー代謝の異常については多くの検討がなされている。我々は、がん細胞において異常を起こしている2つの酵素、1)がん細胞で活性が低下しているピルビン酸脱水素酵素と、2)多くのがんで過剰に発現しているATPクエン酸リアーゼ(ATP citrate lyase)に注目して研究を行っている。
αリポ酸はピルビン酸脱水素酵素の補酵素であり、ヒドロキシクエン酸はATP クエン酸リアーゼの阻害剤である。この2つのサプリメントの組み合わせは、強い抗がん作用を持っている可能性がある。
そこで、培養がん細胞を使ってαリポ酸とヒドロキシクエン酸の抗がん作用における相乗効果を検討した。αリポ酸は用量(0.1 ~10μM)およびがん細胞の種類に応じてがん細胞の数を10~50%減少させた。ヒドロキシクエン酸は10~500μMの濃度でがん細胞の数を5~60%減少させた。ヒドロキシクエン酸とαリポ酸を同時に投与すると、抗腫瘍効果は相乗的に増強し、8μMのαリポ酸と300μMのヒドロキシクエン酸の併用でがん細胞は72時間後に100%死滅した。
健常なマウスに、常用される量のヒドロキシクエン酸とαリポ酸を同時に投与しても、毒性は認められなかった。 マウスのがん細胞(膀胱がん細胞MBT-2、メラノーマ細胞B16-F10、ルイス肺がんLL/2)をマウスに移植した実験モデルで、ヒドロキシクエン酸とαリポ酸の組み合わせによる抗腫瘍効果を検討した。この組み合わせは、腫瘍の縮小や生存期間の延長において、シスプラチンや5-FUなどの通常の抗がん剤と同じレベルの抗腫瘍効果を示した。
基礎実験のレベルではあるが、培養細胞と動物を使った実験の結果から、αリポ酸とヒドロキシクエン酸の組み合わせは有効ながん治療となる可能性が示唆された。臨床試験を行う価値がある。
【要旨】 がん細胞における代謝の異常は、オットー・ワールブルク(Otto Warburg)によって80年以上前に指摘され、ワールブルグ効果(Warburg effect)として知られているが、最近まであまり注目されていなかった。しかし、近年、がんの診断や治療との関連において、がん細胞における代謝やエネルギー産生の異常が注目されるようになった。 著者らは、がん細胞の代謝異常の鍵となる酵素であるATPクエン酸リアーゼとピルビン酸脱水素酵素の活性に作用するヒドロキシクエン酸とアルファリポ酸の抗腫瘍効果に関して基礎研究の結果を報告している。すなわち、3種類のマウスのがん細胞株を使った実験では、ヒドロキシクエン酸とアルファリポ酸の組み合わせは、通常の抗がん剤治療と同等の効果を発揮した。
今回の研究は、通常の抗がん剤治療(特にシスプラチン)の抗腫瘍効果に対して、ヒドロキシクエン酸とアルファリポ酸の組み合わせを併用した場合の影響を明らかにする目的で行った。マウスのがん細胞(LL/2肺がん細胞、MBT-2膀胱がん細胞)を移植したマウスに、通常の抗がん剤(シスプラチンかメソトレキセート)を投与する実験で、アルファリポ酸とヒドロキシクエン酸を組み合わせた製剤を投与した。 シスプラチンまたはメソトレキセートを単独で使用した場合、あるいはアルファリポ酸+ヒドロキシクエン酸を投与した場合に比べて、シスプラチン(またはメソトレキセート)+アルファリポ酸+ヒドロキシクエン酸の3種類を併用した場合は抗腫瘍効果が著明に増強した。(アルファリポ酸+ヒドロキシクエン酸は、シスプラチンあるいはメソトレキセートの抗腫瘍効果を相乗的に高めた) 肝臓転移を有する膵臓がん患者(80歳女性)に、ジェムシタビン(ジェムザール)とアルファリポ酸とヒドロキシクエン酸を併用した治療を行ったところ、顕著な抗腫瘍効果を得ることができた。
動物実験と膵臓がんの症例の経験から、通常の抗がん剤治療に、アルファリポ酸とヒドロキシクエン酸を併用して投与すると、抗腫瘍効果を高めることができることが示唆された。この論文で記載された症例報告の概要を以下に示します。
80歳女性。2009年2月24日にかゆみと倦怠感、黄疸、浮腫の症状にて来院。
CT検査で膵臓の頭部に2cm大の腫瘍を認め、胆管の拡張と肝臓の腫大を認めた。黄疸を改善するために、胆管ドレナージと閉塞した胆管へのステント挿入が行われ、症状が改善した後、5月13日に膵頭十二指腸切除手術が実施された。
組織診断は膵臓の膵管がんで、十二指腸に浸潤を認めた。廓清したリンパ節の70%に転移を認めた。7月6日のCT検査で、肝臓に転移を認めた。腫瘍マーカーのCA19-9は3000以上で、3kg以上の体重減少が認められたため、余命は3~6ヶ月と宣告された。
7月22日からジェムザールによる抗がん剤治療が開始された。ジェムザール(28日に1回1200 mg投与)の効果を高める目的で、次のような代替医療を併用することにした。
Garcinia Cambogia (60% HCA) 1200 mg 毎日経口摂取 アルファリポ酸 1200 mg 毎日経口摂取 Celecoxib (セレブレックス) 200 mg 毎日経口摂取 レチノイン酸 50 mg 隔日経口摂取 メラトニン 20 mg 午後9時毎日経口摂取 プロシュア (Abbott) 2 vials 毎日経口摂取 治療4ヶ月後には肝臓転移は50%に縮小し、7ヶ月後(2009年、12月30日)のCT検査では肝臓の腫瘍は完全に見えなくなった。2010年の3月18日の時点で、当初の予想の3~6ヶ月の余命を超えて、患者はQOL(生活の質)が良い状態で生存していた。しかし、肝臓転移が出現したため、2010年4月から抗がん剤治療をFOLFOXに変更し、ヒドロキシクエン酸、アルファリポ酸、セレブレックス、レチノイン酸、メラトニン、プロシュアに加えて低用量ナルトレキソン(1mg/日)を併用した治療を行っている。
【コメント】
上記の論文の症例報告に関しては、当初の予想の余命を超えて生存していますが、抗がん剤単独と比べて本当に効果があったのかどうかは1例の症例報告だけでは判断は困難です。アルファリポ酸やヒドロキシクエン酸などを併用しなくても結果が変わらなかった可能性は否定できません。この論文が発表される段階で、転移巣が増大したため、抗がん剤の種類を変えたり、代替医療の組み合わせを変えていますので、劇的な効果が得られたわけではありません。
しかし、この症例報告では、代替医療(アルファリポ酸、ヒドロキシクエン酸、COX-2阻害剤のセレブレックス、メラトニン、低用量ナルトレキソン療法)の併用によって、副作用を高めること無く、QOL(生活の質)を良くし、延命効果が得られている可能性が示唆されています。この論文で行われている代替医療の組み合わせは銀座東京クリニックで私が行っている代替医療と同じ方法であり、このような組み合わせの有効性が示唆されます。
以上のことから、理論的にも、また臨床報告からも、抗がん剤治療にアルファリポ酸とヒドロキシクエン酸を併用してみる価値はあると思います。
また、ピルビン酸脱水素酵素キナーゼを阻害してピルビン酸脱水素酵素を活性化するジクロロ酢酸ナトリウムの併用は、αリポ酸とヒドロキシクエン酸の効果を高める可能性があります。(ジクロロ酢酸ナトリウムについてはこちらへ)
また、アルファリポ酸との併用で抗腫瘍効果を高めることが報告されている低用量ナルトレキソン療法の併用も効果が期待できます。(低用量ナルトレキソン療法についてはこちらへ)
さらに、嫌気性解糖系を阻害する半枝蓮の煎じ薬を併用すると、抗腫瘍効果が高まります。(半枝蓮についてはこちらへ)
COX-2阻害剤のセレコックスの併用も有効です。セレコックスには血管新生阻害作用やがん細胞のアポトーシス誘導作用も報告されています。COX-2阻害作用は抗腫瘍免疫の働きを良くする効果もあります。がん細胞で亢進している嫌気性解糖系を抑制し、TCA回路を活性化し、ATPクエン酸リアーゼを阻害する方法を組み合わせると、がん細胞の増殖に必要な細胞成分の合成が阻害され、増殖を抑制することができます。
(がん細胞のエネルギー産生の特徴を利用したがん治療についてはこちらへ)
【ヒドロキシクエン酸の服用量と安全性について】
動物を使った毒性試験ではヒドロキシクエン酸は体重1kg当たり2500mgの摂取でも毒性を示さなかったという報告があります。
人間における安全性の研究も多数行われており、ある報告では、25人の健常人を対象に1日4600mgを60日間摂取する臨床試験の結果、副作用は全く認めなかったという報告があります。
ヒドロキシクエン酸による脂肪合成抑制を目的とした抗がん作用は用量依存的と考えられるので、服用量は多いほど抗腫瘍効果が高いと言えます。今までの安全性の研究から1日2000mg程度の摂取が推奨できると言えます。
【アルファリポ酸の抗がん作用について】
アルファリポ酸(α-lipoic acid、別名:チオクト酸)は、多数の酵素の補助因子として欠かせない体内成分です。特に、TCA回路(クエン酸回路)のピルビン酸脱水素酵素複合体の補助因子として、ミトコンドリアでのエネルギー産生に重要な役割を果たしています。アルファリポ酸はTCAサイクルのアルファケトグルタル酸脱水素酵素複合体も活性化します。
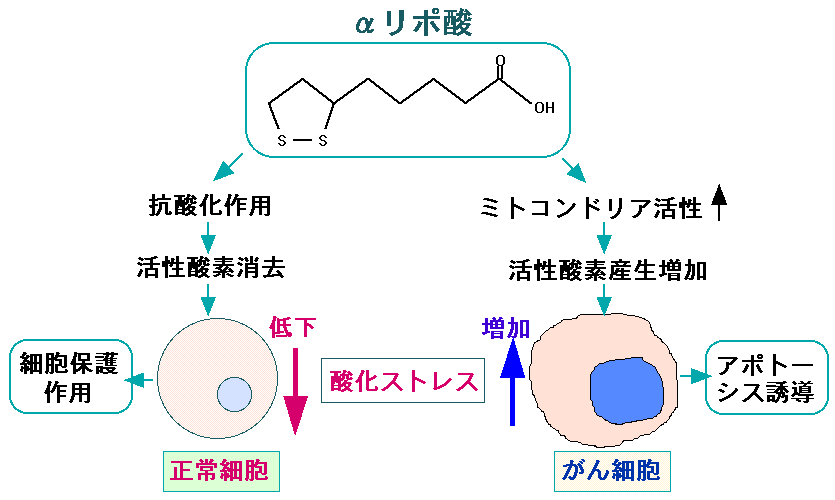
このようにTCA回路の酵素を活性化して、がん細胞のミトコンドリアの酸化的リン酸化を高め、がん細胞を死にやすくする効果があります。
さらに、アルファリポ酸は細胞周期において増殖を促進する蛋白質の活性や量を低下させます。アポトーシスを阻害する因子(bcl-2)の発現を抑え、アポトーシスを促進する因子(bax)の発現を高め、アポトーシスを実行するチトクロームCやAIF(apoptosis inducing factor)のミトコンドリアから核への移行を促進します。これらの複数の機序によって、がん細胞の増殖を止め、アポトーシス(細胞死)を起こりやすくします。
アルファリポ酸は強い抗酸化作用を持っています。正常細胞に対しては、酸化ストレスを軽減して細胞のダメージを軽減し、がん細胞に対してはミトコンドリアの働きを活性化してアポトーシスを起こしやすくする2面的な効果があります。
(アルファリポ酸の詳細はこちらへ)
活性酸素を消去するαリポ酸の抗酸化作用は、正常細胞に対して酸化ストレスを低下させ、細胞の酸化障害を軽減する作用を示す。 しかし一方、がん細胞に対しては、がん細胞で低下しているピルビン酸脱水素酵素の活性を高め、TCA回路と酸化的リン酸化による活性酸素の産生が高めることによって酸化ストレスを増加させて、がん細胞のアポトーシス(細胞死)を誘導する。
【がん細胞のエネルギー産生の特徴:ワールブルグ効果とは】
約80年以上も前(1926年)に、オットー・ワールブルグ(Otto Warburg)博士は、がん細胞ではミトコンドリアにおける酸化的リン酸化によるエネルギー産生が低下し、細胞質における嫌気性解糖系を介したエネルギー産生が増加していることを発見しました。これをワールブルグ効果と言います。
ワールブルグ博士は呼吸酵素(チトクローム)の発見で1931年にノーベル生理学・医学賞を受賞しています。細胞生物学や生化学の領域で、重大な基礎的発見を次々に成し遂げ、呼吸酵素以外の研究でも何回もノーベル賞候補になった偉大な科学者です。そのワールブルグ博士が最も力を注いだのががん細胞のエネルギー代謝の研究です。がん細胞の異常な増殖を解明するためには、エネルギー生成の反応系を研究しなければならないということから、呼吸酵素を発見しています。
そして、1)がん細胞ではグルコースから大量の乳酸を作っていること、2)がん細胞は酸素が無い状態でもエネルギーを産生できること、さらに、3)がん細胞は酸素が十分に存在する状態でも、酸素を使わない方法(嫌気性解糖系)でエネルギーを産生していることを見つけています。
しかし、がん細胞における嫌気性解糖系の亢進(ワールブルグ効果)はがんの原因ではなく、酸素欠乏状態にある結果として仕方なくそうなるのだという意見が主流で、最近まであまり重視されていませんでした。ところが最近、このワールブルグ効果は単なる酸素欠乏の結果ではなく、がん発生のメカニズムにおいて重要な現象であると認識されるようになりました。
すなわち、ミトコンドリアでの酸化的リン酸化を抑制するとアポトーシスを起こしにくくなる、DNAや脂肪など細胞の成分を作るためにグルコースの取込みと解糖系を促進する必要があるなど、ワールブルグ効果はがん細胞の増殖を維持するために必然的な現象だと考えられるようになっています。
細胞は血中のグルコース(ブドウ糖)を取り入れ、解糖系、TCA回路、電子伝達系における酸化的リン酸化系を経て、エネルギー(ATP)を産生している。オットー・ワールブルグ博士は、がん細胞では酸素が十分に利用できる場合でも嫌気性解糖系でのエネルギー産生が主体であることを発見した。
治療に関するご質問やご相談はメール(info@f-gtc.or.jp)か電話(03-5550-3552)でお問合せ下さい。